Genetik hinter einigen schwerwiegenden unerwünschten Arzneimittelwirkungen (SUAW)
Last Updated on January 2, 2021 by Joseph Gut – thasso
02. Januar 2021 – Etwa 95% der Menschen haben Genvarianten, die ihre Reaktion auf mindestens ein Medikament negativ beeinflussen können und zu unerwarteten oder unerwünschten Arzneimittelwirkungen (UAW) oder, wenn sie Pech haben, zu einer schwerwiegenden, wenn nicht tödlichen unerwünschten Arzneimittelwirkung (SUAW) führen können. Tatsächlich sind SUAW eine der Hauptursachen für Morbidität und Mortalität weltweit. Sie belaufen sich auf eine Gesamtinzidenz von SUAW bei Krankenhauspatienten in den USA von schätzungsweise 6,2–6,7%, wobei die Inzidenz tödlicher SUAW auf 0,15–0,3% geschätzt wird. Studien in Europa und Australien liefern ähnliche Schätzungen.
 Einige SUAW können aufgrund der pharmakodynamischen und pharmakokinetischen Eigenschaften eines Arzneimittels vorhersehbar sein. Viele scheinen jedoch idiosynkratisch zu sein (d.h., sie scheinen rational nicht erklärbar zu sein und spiegeln somit unsere Unkenntnis für ihre zugrunde liegenden Mechanismen wider). Genetische Faktoren können der Anfälligkeit für SUAW zugrunde liegen, und die Identifizierung prädisponierender Genotypen kann das Patientenmanagement durch die prospektive Auswahl geeigneter (Arzneimittel-) Kandidaten verbessern. Mehrere spezifische SUAW können die Rolle der Prädisponierung genetischer Risikofaktoren für die Entwicklung von SUAW hervorheben. Dazu gehören Beispiele wie i) schwere medikamenteninduzierte Hautreaktionen, ii) medikamenteninduziertes langes QT Syndrom (LQTS) und Torsades de Pointes (TdP), iii) statininduzierte Myotoxizität und iv) medikamenteninduzierte Leberschädigung, um nur einige zu nennen.
Einige SUAW können aufgrund der pharmakodynamischen und pharmakokinetischen Eigenschaften eines Arzneimittels vorhersehbar sein. Viele scheinen jedoch idiosynkratisch zu sein (d.h., sie scheinen rational nicht erklärbar zu sein und spiegeln somit unsere Unkenntnis für ihre zugrunde liegenden Mechanismen wider). Genetische Faktoren können der Anfälligkeit für SUAW zugrunde liegen, und die Identifizierung prädisponierender Genotypen kann das Patientenmanagement durch die prospektive Auswahl geeigneter (Arzneimittel-) Kandidaten verbessern. Mehrere spezifische SUAW können die Rolle der Prädisponierung genetischer Risikofaktoren für die Entwicklung von SUAW hervorheben. Dazu gehören Beispiele wie i) schwere medikamenteninduzierte Hautreaktionen, ii) medikamenteninduziertes langes QT Syndrom (LQTS) und Torsades de Pointes (TdP), iii) statininduzierte Myotoxizität und iv) medikamenteninduzierte Leberschädigung, um nur einige zu nennen.
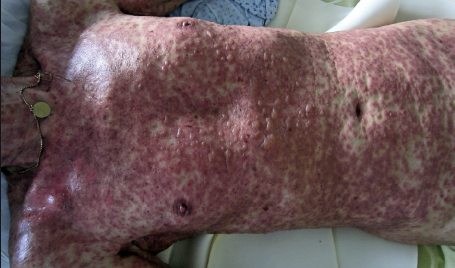
Schwere arzneimittelinduzierte Hautreaktionen
Zu den sehr schwerwiegenden Hautreaktionen zählen das Stevens Johnson Syndrom (SJS) und die toxische epidermale Nekrolyse (TEN, auch als Lyell-Syndrom bekannt), die beispielsweise bei Han-Chinesen, welche unter einer Carbamazepin-Therapie (CBZ) stehen und Träger der allelischen Genvariante HLA-B * 1502 sind, mit sehr hoher Prävalenz auftreten. Tatsächlich entwickeln sich SJS und TEN mit sehr vielen Medikamenten (siehe hier eine Liste solcher Medikamente) und sind stark mit einer Auswahl verschiedener Gen-Allel-Varianten in anderen ethnischen Gruppen verbunden.
Arzneimittelinduzierte lange QT und Torsades de Pointes
Für das medikamenteninduzierte lange QT-Syndrom (LQTS) und Torsades de Pointes (TdP) wurden mehrere klinische Risikomarker identifiziert, insbesondere Hypokaliämie, Hypomagnesiämie, zugrunde liegende Bradykardie, koexistierende Herzerkrankungen und weibliches Geschlecht werden bei der Analyse einer umfassenden Genotyp-Phänotyp-Bewertung berücksichtigt. Zehn Krankheitsgene für angeborenes LQTS wurden identifiziert. Die beiden am häufigsten betroffenen Gene (KCNQ1 und KCNH2 (HERG)) kodieren die spannungsgesteuerten Kaliumkanäle IKs bzw. IKr. Sechs dieser Gene kodieren auch Ionenkanalproteine oder zusätzliche (funktionsmodifizierende) Untereinheiten, und die verbleibenden zwei Krankheitsgene, ANK2 und CAV3, kodieren nicht Ionenkanäle sollen aber die  Kanalfunktion verändern. Das vom ANK2-Gen kodierte Ankyrin-B-Protein scheint auf Calcium-Handling-Proteine auf geeignete Membransubdomänen in Myozyten abzuzielen, während das CAV3-Gen ein Caveolar-Protein kodiert, das die Natriumkanalfunktion zu modifizieren scheint. Jede obige krankheitsassoziierte Mutation stört das Gleichgewicht zwischen nach innen depolarisierenden und nach außen repolarisierenden Strömen während der Repolarisation des Herzens zugunsten eines erhöhten Nettoeinwärtsstroms, was zu verlängerten Aktionspotentialen und damit zu erhöhten QT-Intervallen im Oberflächen-EKG führt. Praktisch alle Medikamente, die Torsades de Pointes verursachen, blockieren IKr / Human Ether-a-go-go-bezogene (HERG) Kanäle. Eine QT-Verlängerung ist eine nachgewiesene Nebenwirkung von Arzneimitteln gegen Herzrhythmusstörungen, kann jedoch auch durch eine Vielzahl von nicht kardialen Arzneimitteln verursacht werden, darunter Antibiotika, Antihistaminika, Opioidanalgetika und Komplementärmedikamente. Es ist eine Datenbank verfügbar, in der Arzneimittel aufgelistet sind, die an LOTS und TdP beteiligt sind, basierend auf ihren Wechselwirkungen mit den oben diskutierten Genen (d.h,. den Proteinen welche sie kodieren).
Kanalfunktion verändern. Das vom ANK2-Gen kodierte Ankyrin-B-Protein scheint auf Calcium-Handling-Proteine auf geeignete Membransubdomänen in Myozyten abzuzielen, während das CAV3-Gen ein Caveolar-Protein kodiert, das die Natriumkanalfunktion zu modifizieren scheint. Jede obige krankheitsassoziierte Mutation stört das Gleichgewicht zwischen nach innen depolarisierenden und nach außen repolarisierenden Strömen während der Repolarisation des Herzens zugunsten eines erhöhten Nettoeinwärtsstroms, was zu verlängerten Aktionspotentialen und damit zu erhöhten QT-Intervallen im Oberflächen-EKG führt. Praktisch alle Medikamente, die Torsades de Pointes verursachen, blockieren IKr / Human Ether-a-go-go-bezogene (HERG) Kanäle. Eine QT-Verlängerung ist eine nachgewiesene Nebenwirkung von Arzneimitteln gegen Herzrhythmusstörungen, kann jedoch auch durch eine Vielzahl von nicht kardialen Arzneimitteln verursacht werden, darunter Antibiotika, Antihistaminika, Opioidanalgetika und Komplementärmedikamente. Es ist eine Datenbank verfügbar, in der Arzneimittel aufgelistet sind, die an LOTS und TdP beteiligt sind, basierend auf ihren Wechselwirkungen mit den oben diskutierten Genen (d.h,. den Proteinen welche sie kodieren).
Statin-induzierte Myotoxizität
Statin-Arzneimittel (d.h., HMG-CoA-Reduktase-Inhibitoren, die derzeit Atorvastatin (Lipitor), Fluvastatin (Lescol), Lovastatin (Mevacor), Pravastatin (Pravachol), Rosuvastatin (Crestor), Simvastatin (Zocor) und Pitavastatin (Livalo) umfassen) reduzieren die Inzidenz von primären und sekundären Erkrankungen der Koronararterien bei Risikopatienten. Im Allgemeinen werden Statine als sicher und wirksam angesehen. Im Laufe der Zeit haben sich jedoch Muskelkomplikationen als ein großes UAW-Problem mit Statin-Medikamenten herausgestellt. Statin-induzierte Muskelkomplikationen scheinen dosisabhängig zu sein und wurden diagnostisch als Myalgie (fokaler oder diffuser Muskelschmerz), Myopathie (Schmerz ohne Entzündung), Myositis (Schmerz, begleitet von einer systemischen Entzündungsreaktion) und Rhabdomyolyse beschrieben. Schwere Muskelschäden, begleitet von Schäden in einem anderen Organ, insbesondere in den Nieren. Klinisch gesehen ist die Rhabdomyolyse die wichtigste und schwerwiegendste (in einigen Fällen sogar tödliche) SUAW im Zusammenhang mit der Statintherapie. Genetisch und molekular gesehen ist die Veranlagung von Patienten für statininduzierte Muskelprobleme sicherlich komplex und kann von Allel-Varianten in Genen abhängen, die für i) Arzneimittelmetabolisierungs-Enzyme, ii) Arzneimitteltransporter, und iii) am Lipid-Stoffwechsel und -Homeostatse beteiligte Enzyme kodieren. Somit wurden über alle Statin-Medikamente gesehen Varianten von Genen wie CYP2C8, CYP3A5, OATP2, OATP1B1 (SLCO1B1), OATPC, OATP1B3 (SLCO1B3), ABCB1 (MDR1), CPT 2, AMPD, PYGM und COQ2 in die Anfälligkeit von Patienten für die Entwicklung von Muskelproblemen einbezogen..
Arzneimittelinduzierte Leberschädigung
Die medikamenteninduzierte Leberschädigung (Hepatotoxizität) ist ein Hauptgrund für regulatorische Maßnahmen gegen die Marktzulassung, die Entfernung vom Markt und die Einschränkung der Verschreibungsindikationen. Die meisten Medikamente, die für schwere Leberschädigung verantwortlich sind, sind keine vorhersehbaren Hepatotoxine. Vielmehr sind sie für die überwiegende Mehrheit der behandelten Patienten über einen weiten Dosisbereich völlig sicher, für eine kleine Untergruppe von Patienten jedoch stark toxisch. Der Beginn einer Leberschädigung ist charakteristischerweise Wochen oder Monate nach Beginn der Therapie verzögert, und die Leberschädigung ist im Allgemeinen diffus. In den meisten Fällen ist unklar, was einige Personen für Lebertoxizität anfällig macht, aber die verfügbaren Daten stützen einen wesentlichen genetischen Beitrag. Die folgende Tabelle fasst einige der Studien zusammen, die statistisch signifikante Assoziationen zwischen Varianten in bestimmten Genen und der Anfälligkeit für schwere Leberschädigungen berichtet haben. Diese Risikofaktoren umfassen genetische Varianten in zwei Hauptkategorien von Genen: die hochpolymorphen Gene im Haupthistokompatibilitätsort auf Chromosom 6, die Antigen-präsentierende Proteine kodieren, und verschiedene polymorphe Gene, welche Arzneimittelmetabolisierungs-Enzyme kodieren. Da die Populationen in diesen Studien im Allgemeinen klein waren, wurden bisher nur häufige Polymorphismen als Suszeptibilitäts-Allele für Leberschädigung getestet.
Tabelle mit einigen ausgewählten Beispielen über genetische Assoziationen mit schweren Leberschäden.
| Medikament | Gene(s) | Medikament-Klasse | Art der Toxizität | Fälle/
Kontrollen |
Ref. |
|---|---|---|---|---|---|
| Ximelagatran | DRB1*07 | Oraler Thrombininhibitor
|
Erhöhung der Transaminase | 74/130 | 1 |
|
|
DQA1*02
|
|
|
|
|
| Tolcapon
|
UGT1A16
|
Catechol-O-Methyltransferase-Inhibitor
|
Asymptomatische Erhöhung der Lebertransaminase
|
135/274
|
2
|
| Diclofenac | UGT2B7 | NSAID | Das Spektrum reicht von akutem Leberversagen bis zu unspezifischen Symptomen mit Transaminase-Erhöhung
|
24/48 | 3 |
| CYP2C8 | |||||
|
|
ABCC2
|
|
|
|
|
| Tranilast‡
|
UGT1A1
|
TGF-α Antagonist
|
Nicht konjugierte Hyper-Bilirubinämie
|
127/909
|
4
|
| Isoniazid | CYP2E1 | Antibiotik | Erhöhung der Serumtransaminasen
|
49/269 | 5 |
|
|
NAT2
|
|
|
|
|
| Isoniazid | GSTM1 | Antibiotik | Ikterische Hepatitis (Serumbilirubin> 3,0 mg / dl)
|
37/33 | 6 |
|
|
NAT2
|
|
Überlegungen im Nachgang
Insgesamt sind dies keine seltenen genetischen Störungen. Genetische Varianten sind normale Unterschiede im DNA-Code zwischen verschiedenen Personen. Tatsächlich sind sie das, was manche Menschen zum Beispiel dazu bringt, blaue und andere braune Augen zu haben. Die Auswirkungen der genetischen Variation werden in der Medizin jedoch noch nicht umfassend berücksichtigt. Die meisten Verschreiber glauben, dass SUAW ein sehr seltenes Ereignis sind, da sie genetisch bedingt seien. Sie denken immer noch, dass das Problem akademischer Natur sei und denken, das sei etwas für die Zukunft. Tatsächlich haben 95% der Menschen eine Genvariante, von der bekannt ist, dass sie ihre Reaktion auf mindestens ein Medikament beeinflusst. Dies ist häufig auf Veränderungen in der Art und Weise zurückzuführen, wie Medikamente vom Körper abgebaut wird. Wenn es ein Medikament metabolisiert wird, kann sich sogar eine Standarddosis des Arzneimittels im Körper zu hohen Konzentrationen aufbauen und schwerwiegende Nebenwirkungen verursachen.
Wenn das Problem auf die Ebene des einzelnen Patienten heruntergebrochen wird, wird es zu einem eher tristischen Thema von Leben und Tod, wie der folgende Fall leider zeigt. So erwähnt Professor Henk-Jan Guchelaar von der Abteilung für klinische Pharmazie der Universität Leiden in den Niederlanden, der in den letzten zwei Jahrzehnten versucht hat, die Verbindung zwischen praktischer Medizin und unseren Genen herzustellen, die Geschichte eines seiner Patienten mit tödliches Ergebnis als Beispiel. Der Patient erzählte Prof. Guchelaar von seiner Frau, die Brustkrebs hatte und operiert wurde. Die Prognose war sehr gut. Der Tumor wurde vom Chirurgen entfernt, aber um Mikrometastasen zu verhindern, musste seine Frau sechs prophylaktische Runden des Chemotherapeutikums Fluorouracil erhalten. Während der zweiten Infusion des Arzneimittels brach der Patient zusammen, wurde auf die Intensivstation verlegt, wo sie starb. Eine später entnommene Blutprobe zeigte, dass sie Trägerin einer Variante des DPYD-Genes war, von der bekannt ist, dass sie den Patienten für potenziell tödliche Wirkungen unter Fluorouracil-Therapie prädisponiert. Die Tragödie in diesem Fall ist, dass die Frau eine sehr gute Prognose hatte (d.h., der primäre Tumor war verschwunden) und wenn sie vor die Therapie mit Fluorouracil auf die bekannten potenziell tödlichen genetischen Varianten von DYPD getestet worden wäre, ist es sehr wahrscheinlich, dass sie diese schwere Arzneimittelreaktion nicht gehabt hätte und noch am Leben wäre, da die behandelnden Ärzte eine alternative Behandlung gewählt hätten.
Die Verschreibung von Arzneimitteln und das Nachdenken über das Nutzen-Risiko-Verhältnis, einschließlich der Risikoanalyse für die Anfälligkeit der einzelnen Patienten für SUAW, könnte einen echten Fortschritt in der personalisierten Medizin oder sogar noch besser in der theragenomischen Medizin darstellen. Letztere berücksichtigt den gesamten genetischen Hintergrund (einschließlich weiterer beitragender Störfaktoren und Interaktionen) bei der Therapie des Individuums mit einem bestimmten Medikament für eine bestimmte Indikation.
Hier finden Sie eine Sequenz zu Aspekten von schweren unerwünschten Arzneimittelwirkungen (SUAW) anhand von Patienten-Beispielen:

