Suspension de la mise sur le marché des produits éclaircissants de la peau présentés en solution injectable
Last Updated on avril 7, 2016 by Joseph Gut – thasso
07 avril 2016 – Ce message vient de l’ANSM et se reflète dans leur formulation:
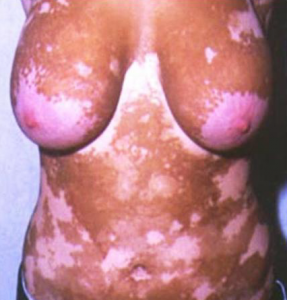 Des produits non autorisés et potentiellement dangereux, destinés à un éclaircissement ou à un blanchiment de la peau et utilisés par voie injectable sont vendus sur internet sous différentes appellations, en infraction avec les dispositions qui leur sont applicables. Ces produits, du fait de leur mode d’administration, répondent à la définition du médicament et n’ont donc pas lieu d’être sur le marché. L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) rappelle que les médicaments doivent faire l’objet d’une autorisation de mise sur le marché (AMM) et que leur vente est réservée aux pharmaciens. Considérant que ces produits présentent un risque pour la santé, l’ANSM a décidé de suspendre leur mise sur le marché.
Des produits non autorisés et potentiellement dangereux, destinés à un éclaircissement ou à un blanchiment de la peau et utilisés par voie injectable sont vendus sur internet sous différentes appellations, en infraction avec les dispositions qui leur sont applicables. Ces produits, du fait de leur mode d’administration, répondent à la définition du médicament et n’ont donc pas lieu d’être sur le marché. L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) rappelle que les médicaments doivent faire l’objet d’une autorisation de mise sur le marché (AMM) et que leur vente est réservée aux pharmaciens. Considérant que ces produits présentent un risque pour la santé, l’ANSM a décidé de suspendre leur mise sur le marché.
Le réseau des Centres antipoison (CAP) a signalé à l’ANSM la présence sur le marché français de produits éclaircissants ou blanchissants de la peau vendus sur internet et présentés en solution injectable (pour injection par voie intramusculaire, intraveineuse, intradermique ou sous-cutanée). Ces produits peuvent contenir des substances telles que du glutathion (utilisé comme excipient dans des médicaments), du facteur de croissance épidermique (Epidermal Growth Factor) mais également différentes autres substances.
Une analyse de la base de données des Centres antipoison a montré que des cas d’exposition à ces produits leur avaient été signalés, cas pouvant être associés à des effets indésirables (nausées, gêne abdominale, vertiges, palpitations).
| L’ANSM rappelle :
Ces produits sont en infraction avec les règles qui leur sont applicables : En effet, la voie d’administration de ces produits (voie injectable) peut faire penser qu’il s’agit d’un médicament. Or, il est rappelé que tout médicament doit faire l’objet d’une autorisation de mise sur le marché (AMM), et que la vente de médicament est réservée aux pharmaciens. Ces produits présentent des risques pour la santé :
|
Ayant considéré que ces produits répondaient à la définition du médicament[1] et que le fait d’administrer par voie injectable des produits dont la sécurité n’a pas été établie représente un risque grave pour la santé, l’ANSM a décidé de suspendre leur mise sur le marché.
Il est important de signaler que ce phénomène n’est pas isolé en France puisque la Food and Drug Administration (FDA) a également mis en garde les consommateurs sur l’utilisation de ces produits aux Etats-Unis fin 2015.

 (283 ko)
(283 ko)
0 Commentaire sur «Suspension de la mise sur le marché des produits éclaircissants de la peau présentés en solution injectable»