Génétique à l’origine de certaines réactions indésirables graves aux médicaments (EI graves)

Last Updated on décembre 31, 2020 by Joseph Gut – thasso
31 décembre 2020 – Environ 95% des personnes présentent des variantes génétiques qui peuvent affecter négativement leur réponse à au moins un médicament, entraînant des réactions médicamenteuses inattendues ou indésirables (EI) ou, en cas de malchance, une réaction indésirable grave (EI grave), voire mortelle, à un médicament. En effet, les EI graves sont une cause majeure de morbidité et de mortalité dans le monde, représentant une incidence globale de EI grave chez les patients hospitalisés aux États-Unis d’environ 6,2 à 6,7%, avec une incidence de EI grave mortels estimée à 0,15 à 0,3%, et des études en Europe et en Australie donnant des estimations similaires.
 Certains EI graves peuvent être prévisibles, sur la base des propriétés pharmacodynamiques et pharmacocinétiques d’un médicament. Beaucoup, cependant, semblent être idiosyncratiques (c’est-à-dire, apparemment pas explicables rationnellement et reflétant ainsi notre manque de compréhension de leurs mécanismes sous-jacents). Des facteurs génétiques peuvent sous-tendre la sensibilité aux EI graves et l’identification de génotypes prédisposants peut améliorer la prise en charge des patients grâce à la sélection prospective de candidats médicaments appropriés. Plusieurs EI graves spécifiques peuvent souligner le rôle des facteurs de risque génétiques prédisposants sur le développement des EI graves. Parmi ceux-ci, on trouve des exemples tels que i) des réactions cutanées sévères induites par un médicament, ii) un QT long induit par un médicament et des torsades de pointes, iii) une myotoxicité induite par des statines et iv) une lésion hépatique induite par un médicament, pour n’en citer que quelques-uns.
Certains EI graves peuvent être prévisibles, sur la base des propriétés pharmacodynamiques et pharmacocinétiques d’un médicament. Beaucoup, cependant, semblent être idiosyncratiques (c’est-à-dire, apparemment pas explicables rationnellement et reflétant ainsi notre manque de compréhension de leurs mécanismes sous-jacents). Des facteurs génétiques peuvent sous-tendre la sensibilité aux EI graves et l’identification de génotypes prédisposants peut améliorer la prise en charge des patients grâce à la sélection prospective de candidats médicaments appropriés. Plusieurs EI graves spécifiques peuvent souligner le rôle des facteurs de risque génétiques prédisposants sur le développement des EI graves. Parmi ceux-ci, on trouve des exemples tels que i) des réactions cutanées sévères induites par un médicament, ii) un QT long induit par un médicament et des torsades de pointes, iii) une myotoxicité induite par des statines et iv) une lésion hépatique induite par un médicament, pour n’en citer que quelques-uns.
Réactions cutanées sévères induites par le médicament
Ainsi, les réactions cutanées très graves comprennent le syndrome de Stevens Johnson (SJS) et la nécrolyse épidermique toxique (NET) qui se produisent avec une prévalence très élevée, par exemple, chez les patients Chinois Han sous traitement anticonvulsivant à la carbamazépine (CBZ) et sont porteurs du variant du gène allélique HLA-B * 1502. En fait, le SJS et le NET se développent avec de très nombreux médicaments (voir ici une liste de ces médicaments) et sont fortement associés à une sélection de différents variants alléliques de gènes dans d’autres groupes ethniques.
QT long induit par le médicament et torsades de pointes
Pour le syndrome du QT long induit par le médicament (SQTL) et les Torsades de pointes (TdP), de multiples marqueurs de risque clinique, notamment l’hypokaliémie, l’hypomagnésémie, la bradycardie sous-jacente, les cardiopathies coexistantes et le sexe féminin, ont été identifiés et sont pris en compte dans l’analyse de toute évaluation complète du génotype-phénotype. Dix gènes de maladie pour le SQTL congénital ont été identifiés. Les deux gènes les plus fréquemment affectés (KCNQ1 et KCNH2 (HERG)) codent pour les canaux potassiques voltage-dépendants sous-jacents aux courants IK et IKr, respectivement. Six de ces gènes codent également pour des protéines de canal ionique ou des sous-unités auxiliaires (modifiant la fonction), et les deux gènes de maladie restants, ANK2 et CAV3, ne codent pas pour les canaux ioniques mais sont censés modifier la fonction du canal. La protéine ankyrine-B codée par 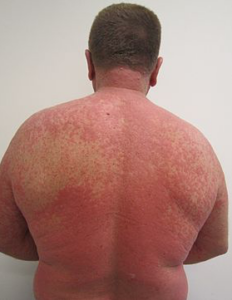 le gène ANK2 semble cibler les protéines manipulant le calcium vers des sous-domaines membranaires appropriés dans les myocytes, tandis que le gène CAV3 code pour une protéine cavéolaire qui semble modifier la fonction des canaux sodiques. Chaque mutation associée à la maladie ci-dessus perturbe l’équilibre entre les courants de dépolarisation vers l’intérieur et de repolarisation vers l’extérieur pendant la repolarisation cardiaque en faveur d’une augmentation du courant entrant net, ce qui entraîne des potentiels d’action prolongés et, par conséquent, une augmentation des intervalles QT sur l’ECG de surface. Pratiquement tous les médicaments qui provoquent des torsades de pointes bloquent les canaux IKr / human éther-a-go-go (HERG). L’allongement de l’intervalle QT est un effet indésirable établi des médicaments anti-arythmiques, mais peut également être causé par un large éventail de médicaments non cardiaques, y compris les antibiotiques, les antihistaminiques, les analgésiques opioïdes et les médicaments complémentaires. Il existe une base de données disponible qui répertorie les médicaments impliqués dans SQTL et TdP en fonction de leurs interactions avec les gènes (c’est-à-dire, leur codage pour les protéines) discutés ci-dessus.
le gène ANK2 semble cibler les protéines manipulant le calcium vers des sous-domaines membranaires appropriés dans les myocytes, tandis que le gène CAV3 code pour une protéine cavéolaire qui semble modifier la fonction des canaux sodiques. Chaque mutation associée à la maladie ci-dessus perturbe l’équilibre entre les courants de dépolarisation vers l’intérieur et de repolarisation vers l’extérieur pendant la repolarisation cardiaque en faveur d’une augmentation du courant entrant net, ce qui entraîne des potentiels d’action prolongés et, par conséquent, une augmentation des intervalles QT sur l’ECG de surface. Pratiquement tous les médicaments qui provoquent des torsades de pointes bloquent les canaux IKr / human éther-a-go-go (HERG). L’allongement de l’intervalle QT est un effet indésirable établi des médicaments anti-arythmiques, mais peut également être causé par un large éventail de médicaments non cardiaques, y compris les antibiotiques, les antihistaminiques, les analgésiques opioïdes et les médicaments complémentaires. Il existe une base de données disponible qui répertorie les médicaments impliqués dans SQTL et TdP en fonction de leurs interactions avec les gènes (c’est-à-dire, leur codage pour les protéines) discutés ci-dessus.
Myotoxicité induite par les statines
Statines (c’est-à-dire les inhibiteurs de l’HMG CoA réductase, qui comprennent actuellement l’atorvastatine (Lipitor), la fluvastatine (Lescol), la lovastatine (Mevacor), la pravastatine (Pravachol), la rosuvastatine (Crestor), la simvastatine (Zocor) et la pitavastatine ( Livalo)) réduisent l’incidence de la coronaropathie primaire et secondaire chez les patients à risque. En général, les statines sont considérées à la fois comme sûres et efficaces. Cependant, au fil du temps, les complications musculaires sont devenues un problème majeur des effets indésirables des statines. Les complications musculaires induites par les statines semblent être dose-dépendantes et elles ont été décrites diagnostiquement comme une myalgie (douleur musculaire focale ou diffuse), une myopathie (douleur en l’absence d’inflammation), une myosite (douleur accompagnée d’une réponse inflammatoire systémique) et une rhabdomyolyse ( lésions musculaires sévères accompagnées de lésions dans un autre organe, notamment les reins. La rhabdomyolyse est l’EI la plus importante et la plus grave (voire mortelle dans certains cas) associée à un traitement par statines. Prédispositions des patients à une statine les problèmes musculaires sont certainement complexes et peuvent dépendre de variantes alléliques dans les gènes codant pour i) les enzymes métabolisant les médicaments, ii) les transporteurs de médicaments et iii) les enzymes impliquées dans le métabolisme et l’homéostasie des lipides. Ainsi, dans tous les statines, des variants de gènes tels que CYP2C8, CYP3A5, OATP2, OATP1B1 (SLCO1B1), OATPC, OATP1B3 (SLCO1B3), ABCB1 (MDR1), CPT 2, AMPD, PYGM et COQ2 ont été impliqués dans la sensibilité des patients pour développer des problèmes musculaires.
Lésions hépatiques d’origine médicamenteuse
Les lésions hépatiques d’origine médicamenteuse sont l’une des principales raisons des mesures réglementaires contre l’autorisation de mise sur le marché, le retrait du marché et la restriction des indications de prescription. La plupart des médicaments responsables des lésions hépatiques sévères ne sont pas des hépatotoxines prévisibles. Au contraire, ils sont totalement sûrs sur une large gamme de doses pour la grande majorité des patients traités, mais gravement toxiques pour un petit sous-ensemble de patients. L’apparition d’une lésion hépatique est généralement retardée de plusieurs semaines ou mois après le début du traitement, et l’atteinte hépatique est généralement diffuse. Dans la plupart des cas, on ne sait pas ce qui rend certains individus sensibles à la toxicité hépatique, mais les données disponibles soutiennent une contribution génétique substantielle. Le tableau ci-dessous résume certaines des études qui ont rapporté des associations statistiquement significatives entre les variants de gènes spécifiques. Ces facteurs de risque impliquent des variantes génétiques dans deux grandes catégories de gènes: les gènes hautement polymorphes dans le locus majeur d’histocompatibilité sur le chromosome 6, qui codent pour les protéines présentatrices d’antigène, et divers gènes polymorphes qui codent pour les enzymes métabolisant les médicaments. Étant donné que les populations dans ces études étaient généralement petites, jusqu’à présent, seuls les polymorphismes courants ont été testés comme allèles de sensibilité pour lésions hépatiques graves.
Voir ici un tableau résumant quelques rapports sélectionnés d’associations génétiques avec lésions hépatiques graves:
| Medicament | Gène | Classe de medicament | Forme de toxicité | Cas / contrôles | références |
|---|---|---|---|---|---|
| Ximelagatran | DRB1*07 | Inhibiteur de la thrombine orale
|
Élévation des transaminases | 74/130 | 1 |
|
|
DQA1*02
|
|
|
|
|
| Tolcapone
|
UGT1A16
|
Inhibiteur de la catéchol-O-méthyltransférase
|
Élévation asymptomatique des transaminases hépatiques
|
135/274
|
2
|
| Diclofénac | UGT2B7 | AINS | De l’insuffisance hépatique aiguë aux symptômes non spécifiques avec élévation des transaminases
|
24/48 | 3 |
| CYP2C8 | |||||
|
|
ABCC2
|
|
|
|
|
| Tranilast
|
UGT1A1
|
Antagoniste du TGF-α
|
Hyper-bilirubinémie non conjuguée
|
127/909
|
4
|
| Isoniazide | CYP2E1 | Antibiotique | Élévation des transaminases sériques
|
49/269 | 5 |
|
|
NAT2
|
|
|
|
|
| Isoniazide | GSTM1 | Antibiotique | Hépatite ictérique (bilirubine sérique> 3,0 mg / dL)
|
37/33 | 6 |
|
|
NAT2
|
|
Après réflexions
Dans l’ensemble, ce ne sont pas des troubles génétiques rares. Les variantes génétiques sont des différences normales dans le code ADN entre différentes personnes. En fait, c’est ce qui fait que certaines personnes ont les yeux bleus et d’autres marrons, par exemple. Mais l’impact de la variation génétique n’est pas encore largement pris en compte en médecine. La plupart des prescripteurs pensent que parce que c’est génétique, il s’agit d’un événement très rare. Ils pensent toujours que c’est académique. Ils pensent que c’est quelque chose pour l’avenir. En fait, 95% des personnes ont une variante génétique connue pour affecter leur réponse à au moins un médicament. Cela est souvent dû à des changements dans la façon dont il est décomposé par le corps. S’il est métabolisé lentement, même une dose standard du médicament peut atteindre des niveaux élevés dans le corps et provoquer des réactions indésirables graves. En décomposant le problème au niveau du patient individuel, il devient une question plutôt triste de vie ou de mort, comme l’illustre tristement le cas suivant. Ainsi, le professeur Henk-Jan Guchelaar, du département de pharmacie clinique de l’Université de Leiden aux Pays-Bas, qui a passé les deux dernières décennies à essayer de faire le lien entre la médecine et nos gènes, évoque juste l’histoire d’un de ses patients avec issue fatale comme point au cas. Le patient a parlé au professeur Guchelaar de sa femme, qui avait un cancer du sein et a subi une intervention chirurgicale. Le pronostic était très bon. La tumeur a été enlevée par le chirurgien mais, pour éviter les micro-métastases, sa femme a dû suivre six traitements de chimiothérapie fluorouracile. Lors de la deuxième perfusion du médicament, le patient s’est effondré, est allé à l’unité de soins intensifs et est décédé. Un échantillon de sang prélevé plus tard a montré qu’elle était porteuse d’une variante du gène DPYD qui est connue pour prédisposer la patiente à des effets potentiellement mortels sous traitement au fluorouracile. La tragédie dans ce cas est que la femme avait un très bon pronostic (c’est-à-dire que la tumeur avait disparu) et si elle avait été testée au préalable avec le traitement au fluorouracile pour les variantes génétiques potentiellement mortelles connues du DYPD, il était très probable qu’elle ne ont eu cette grave réaction médicamenteuse et seraient toujours en vie.
La prescription de médicaments et la réflexion sur les ratios risques-bénéfices, y compris l’analyse des risques pour les susceptibilités individuelles des patients au EI graves, pourraient constituer un véritable pas en avant dans la médecine personnalisée, voire mieux dans la médecine théragénomique. Cette dernière prend en compte l’ensemble des antécédents génétiques (y compris les facteurs de confusion) dans la thérapie de l’individu avec un médicament donné pour une indication donnée.
Voir ici une séquence sur les facteurs génétiques affectant les réactions indésirables aux médicaments (EI).

