Widerruf der Zulassung fusafunginhaltiger Arzneimittel: Rote-Hand-Brief des BfArM
Last Updated on May 16, 2016 by Joseph Gut – thasso
26. April 2016 – Mittels Rote-Hand-Brief informiert die betroffene Firma, Les Laboratories Servier, die Fachkreise über den Widerruf der Zulassungen von fusafunginhaltiger Arzneimitteln (Locabiosol, angewendet als Mund/Nasenspray) innerhalb der Europäischen Union (EU) gemäss der Mitteilung des Europäischen Ausschusses für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) vom 12. Februar 2016. Die Arzneimittel wurden zur symptomatischen Behandlung von oberen Atemwegsinfektionen wie Sinusitis, Rhinitis, Rhinopharyngitis, Angina, Laryngitis, und Tracheitis eingesetzt. Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) beabsichtig mit Wirkung zum 28. Mai 2016 den Widerruf der Zulassungen fusafunginhaltiger Arzneimittel anzuordnen, d.h. Fusafungin-haltige Arzneimittel werden ab diesem Datum nicht mehr am Markt zur Verfügung stehen.
Fusafungin ist ein Antibiotikum, das aus dem Pilz Fusarium lateritium (WR Stamm 437) oder anderen Fusarium-Arten gewonnen wird. Chemisch gesehen handelt es sich dabei um ein ionophores Peptid-Antibiotikum, das ein Gemisch aus Enniatin A, B, C und möglicherweise weiteren Komponenten darstellt. Enniatine sind cyclische
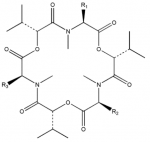
Depsipeptide, in deren ringförmigem Grundgerüst sich die Peptidbindung R–CO–NH–R’ mit der Esterbindung R–CO–O–R’ jeweils dreimal abwechselt und damit ein Cyclohexadepsipeptide darstellt. Fusafungin ist gegen verschiedene grampositive und gramnegative Keime sowie Candida albicans wirksam. Dabei wirkt es bakteriostatisch und bakteriozid. Außerdem besitzt es eine eigene entzündungshemmende Wirkungskomponente.
Die Entscheidung, die Zulassung von Fusafungin-haltigen Arzneimitteln zu widerrufen, basiert auf Bedenken hinsichtlich seltener, jedoch schwerwiegender Fälle von Überempfindlichkeitsreaktionen, darunter allergische und lebensbedrohliche anaphylaktische Reaktionen, welche die EMA veranlasst hatten, eine neue Bewertung aller verfügbaren Wirksamkeits- und Sicherheitsdaten von Fusafungin-haltigen Arzneimitteln einzuleiten. Diese Überprüfung durch den Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) ergab, dass die Mehrzahl der schwerwiegenden Überempfindlichkeitsreaktionen bald nach Anwendung des Medikamentes auftrat und Bronchospasmen einschloss. Obwohl diese Reaktionen selten sind, können sie lebensbedrohlich sein. Der PRAC war der Ansicht, dass keine Maßnahmen zur ausreichenden Risikoreduktion identifiziert wurden.
Hinsichtlich des Nutzens überprüfte der PRAC alle verfügbaren Wirksamkeitsdaten, einschließlich Daten, die seit der ersten Marktzulassung erhältlich waren. Der PRAC schlussfolgerte, dass die Evidenz für den Nutzen von Fusafungin in allen zugelassenen Indikationen gering und klinisch nicht relevant sei. Zusätzlich konnte das Risiko einer Kreuzresistenz nicht ausgeschlossen werden, obwohl die Datenlage unzureichend ist, um das Risiko einer bakteriellen Resistenzbildung abschätzen zu können. Unter Berücksichtigung des leichten und selbstlimitierenden Verlaufes von Erkrankungen der oberen Atemwege, wie einer Rhinopharyngitis, kam der PRAC zu dem Ergebnis, dass der Nutzen von Fusafungin die Risiken nicht überwiegt. Darüber hinaus wird die Anwendung von Fusafungin von klinischen Leitlinien nicht gestützt.
Basierend auf diesen momentan verfügbaren Daten schlussfolgerte der PRAC, dass das Nutzen-Risiko- Verhältnis für Fusafungin-haltige Arzneimittel negativ ist und die Zulassung in der Europäischen Union (EU) widerrufen werden sollte.


Parallel zur Mitteilung des BfArM hat am 18. April 2016 auch Swissmedic, das Schweizerische Heilmittelinstitut, den Widerruf der Zulassung und Marktrücknahme von Fusafungin (Lacobiotal) durch die Zulassungsinhaberin Servier (Suisse) SA in der Schweiz bekanntgegeben.
<https://www.swissmedic.ch/marktueberwachung/00135/00157/03344/index.html?lang=de>