Teratogenes Risiko von Mycophenolat Mofetil -haltigen Arzneimitteln
Last Updated on February 26, 2016 by Joseph Gut – thasso
22 Februar 2016 – Sowohl Swissmedic, das Schweizerische Heilmittel-Institut, wie auch das deutsche Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) haben kürzlich neue Kontraindikationen und wichtige neue Hinweise zu Schwangerschaftstests sowie zur Schwangerschaftsverhütung bei Frauen und Männern für CellCept und für Mycophenolat Mofetil-haltige Arzneimittel im allgemeinen zum teratogenen Risiko von Mycophenolat Mofetil erlassen. Nach Swissmedic hat dabei die Zulassungsinhaberin von CellCept in der Schweiz, die Roche Pharma (Schweiz) AG wie folgt informiert:
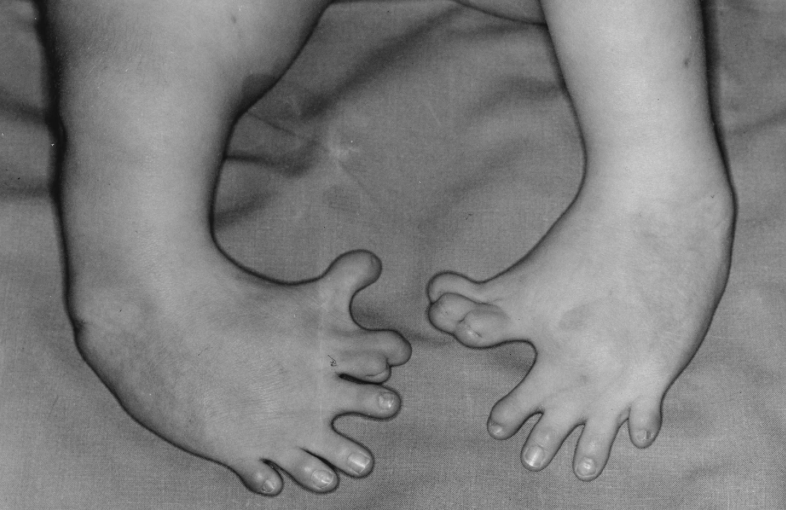
Mycophenolat Mofetil ist ein potentes humanes Teratogen, welches nach Exposition während einer Schwangerschaft das Risiko für Spontanaborte und kongenitale Fehlbildungen erhöht. Basierend auf dem bekannten teratogenen Potenzial ist CellCept (Mycophenolat Mofetil) in der Schwangerschaft daher kontraindiziert.
CellCept ist neu zusätzlich in folgenden Fällen kontraindiziert:
- bei Frauen im gebärfähigen Alter, die keine hochwirksamen Methoden zur Schwangerschaftsverhütung anwenden
- bei stillenden Frauen
Vor Beginn der Behandlung müssen weibliche und männliche fortpflanzungsfähige Patienten auf das erhöhte Risiko einer Fehlgeburt während der Schwangerschaft sowie von angeborenen Fehlbildungen hingewiesen und bezüglich der Prävention und Planung einer Schwangerschaft beraten werden. Des Weiteren sollten diese Patienten über die Notwendigkeit informiert werden, im Falle einer möglichen Schwangerschaft unverzüglich einen Arzt bzw. eine Ärztin zu kontaktieren.
Im Zulassungsbereich der Swissmedic werden in der Folge die Arzneimittelinformationen aller Mycophenolat Mofetil-haltigen Arzneimittel in gleicher Weise angepasst. Dies trifft insbesondere für Mycophenolat Spirig HC (Zulassung 62837), Myfenax (Zulassung 59221), Mycophenolat-Mofetil Sandoz (Zulassung 58674), und Myfortic (Zulassung 56115) zu.
Zufolge von Unklarheiten bei Patientinnen und Patienten hat das BfArM kürzlich folgende präzisierende Mitteilung zur verschärften Warnungen zur Anwendung von Mycophenolat (Mycophenolat Mofetil oder Mycophenolsäure) in der Schwangerschaft publiziert, welche sinngemäß auch im Zulassungsbereich der Swissmedic zutrifft:
Die Frage, ob auch die Therapie des Vaters mit mycophenolathaltigen Arzneimitteln zu einem erhöhten Fehlbildungsrisiko in der Schwangerschaft führt, kann aufgrund der derzeitigen Datenlage nicht sicher beantwortet werden. Eine sehr begrenzte Anzahl von Daten deutet bisher nicht auf ein erhöhtes Risiko für Fehlbildungen und Fehlgeburten nach väterlicher Exposition mit Mycophenolat hin (Jones et al., 2013). Jedoch hat sich Mycophenolat in in vitro /in vivo Untersuchungen als potentiell genotoxisch (gen-verändernd) erwiesen (Fachinformation des BfArM zu CellCept, Stand November 2015). Ein erhöhtes Fehlbildungsrisiko in der Schwangerschaft durch die väterliche Exposition mit Mycophenolat kann daher weder nachgewiesen noch ausgeschlossen werden.
Vorbeugend wird sexuell aktiven Männern daher als Vorsichtsmaßnahme empfohlen, während der Behandlung und für mindestens 90 Tage nach Beendigung der Behandlung Kondome zu benutzen. Die Anwendung von Kondomen gilt sowohl für fortpflanzungsfähige Männer als auch für Männer mit Vasektomie, da die Risiken, die mit dem Transfer von Samenflüssigkeit verbunden sind, auch bei Männern mit Vasektomie bestehen könnten. Zusätzlich wird Partnerinnen von Patienten empfohlen, während der Behandlung und noch insgesamt 90 Tage nach der letzten Dosis von Mycophenolat des Partners eine hochwirksame Verhütungsmethode anzuwenden.
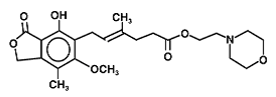
Mycophenolat-Mofetil (auch Mykophenolatmofetil oder Mykophenolat-Mofetil, MMF) ist ein Arzneistoff, der die Wirkung des Immunsystems unterdrückt (Immunsuppressivum). Es wird vor allem in Kombination mit Ciclosporin und Corticosteroiden zur Prophylaxe von akuten Transplantatabstoßungsreaktionen bei Patienten mit allogener Nieren-, Herz- oder Lebertransplantation eingesetzt.


I blog frequently and I truly thank you for your information.
This great article has really peaked my interest.
I’m going to bookmark your site and keep checking
for new details about once per week. I subscribed to your Feed too.
Gemäss dem Deutschen Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) hat die Novartis Pharma AG in einem Rote-Hand-Brief zu Myfortic® soeben darüber informiert, dass die Hinweise bezüglich einer Schwangerschaftsverhütung bei der Anwendung von Mycophenolsäure deutlich verschärft wurden. Dies erfolgt analog zu den bereits veröffentlichten Hinweisen zu CellCept® (Mycophenolatmofetil), bei dem ebenfalls Mycophenolsäure als aktiver Metabolit freigesetzt wird, und ist auf der Linie des oben stehenden Artikels. Den exakten Wortlaut der BfArM-Mitteilung finden sie hier: http://www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RHB/2016/rhb-myfortic.html. Den Rote-Hand-Brief der Firma Novartis finden sie hier: http://www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RHB/2016/rhb-myfortic.pdf?__blob=publicationFile&v=2