Risque de réactions cutanées graves avec le KEYTRUDA (pembrolizumab)
Last Updated on mars 22, 2017 by Joseph Gut – thasso
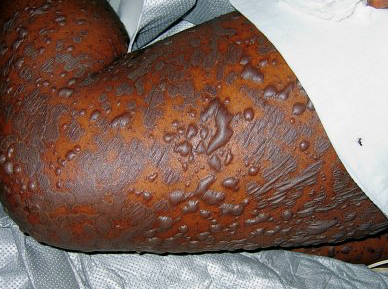
22 mars 2017 – Selon Santé Canada, des cas de syndrome de Stevens-Johnson (SSJ) et de nécrolyse épidermique toxique (NET (syndrome de Lyell)) ont été signalés à l’échelle mondiale au cours des études cliniques et après la commercialisation du produit KEYTRUDA (pembrolizumab). Huit cas de SSJ, dont un cas mortel, et deux cas de NET, dont un cas mortel, ont été dénombrés. Parmi tous ces cas, un cas de SSJ a été déclaré au Canada.

En Canada, KEYTRUDA (pembrolizumab), un anticorps bloquant le récepteur 1 de mort cellulaire programmée (PD 1), est indiqué pour le traitement des patients atteints d’un mélanome non résécable ou métastatique n’ayant jamais été traités avec l’ipilimumab (YERVOY). KEYTRUDA (pembrolizumab) est également autorisé, en vertu de la politique sur les avis de conformité avec conditions a) pour le traitement des patients atteints d’un mélanome non résécable ou métastatique avec progression de la maladie à la suite d’un traitement avec l’ipilimumab et, en présence d’une mutation V600 du gène BRAF, à la suite d’un traitement avec un inhibiteur du gène BRAF ou de la protéine MEK, et b) d’un cancer du poumon non à petites cellules (CPNPC) métastatique dont les cellules tumorales expriment le PD-L1 (conformément aux résultats d’un test validé), et dont la maladie a progressé pendant ou après une chimiothérapie à base de platine.
Le risque potentiel de SSJ et de NET associé à l’utilisation de KEYTRUDA (pembrolizumab) a été évalué d’après les données d’innocuité actuellement accessibles dans les articles publiés et la base de données mondiale sur l’innocuité du fabricant (qui contient à la fois les données sur les effets indésirables graves observés pendant les études cliniques et les rapports sur les effets indésirables survenus après la commercialisation). À l’échelle mondiale, un cas de SSJ mortel a été signalé chez un patient traité avec KEYTRUDA (pembrolizumab) au cours d’une étude clinique et un cas de NET mortelle a été signalé chez un patient recevant le produit après sa commercialisation. Ces deux cas inclus, un total de huit cas de SSJ (six au cours d’études cliniques et deux après commercialisation) et de deux cas de NET (tous deux après commercialisation) ont été dénombrés. Sur les dix cas signalés, un cas de SSJ est survenu au Canada et deux cas faisaient état d’une association temporelle avec l’utilisation de KEYTRUDA (pembrolizumab), comportaient peu de facteurs de confusion et incluaient des biopsies qui concordaient avec le SSJ ou la NET. Approximativement 11 000 patients ont été traités avec KEYTRUDA (pembrolizumab) dans les études cliniques et 27 000 patients l’ont reçu après sa commercialisation.
Aux professionnels de la santé, tels que les oncologues, le personnel infirmier, les pharmaciens d’hôpital, le personnel de salle d’urgence et le personnel de centre de cancérologie, c’est recommandé de
- Conseiller les patients en fonction des avantages et des risques associés à KEYTRUDA (pembrolizumab), y compris le risque et les symptômes précoces de SSJ et de NET.
- Interrompre le traitement avec KEYTRUDA (pembrolizumab) et consulter un spécialiste pour une évaluation et un traitement immédiats en présence de réaction cutanée grave ou d’un cas soupçonné de SSJ ou de NET.
- Cesser définitivement tout traitement avec KEYTRUDA (pembrolizumab) en présence d’un cas confirmé de SSJ ou de NET.
La gestion des effets secondaires liés à un produit de santé commercialisé dépend de leur déclaration par les professionnels de la santé et les consommateurs. Tout cas de réaction cutanée grave, de SSJ ou de NET soupçonnés ou tout autre effet indésirable grave ou imprévu chez les patients recevant KEYTRUDA (pembrolizumab) doit être signalé à Merck Canada Inc. ou à Santé Canada.
Merck Canada Inc., Pharmacovigilance
16750, route Transcanadienne
Kirkland (Québec) H9H 4M7
Télécopieur : 1-800-369-3090
Direction des produits de santé commercialisés
Courriel : mhpd_dpsc@hc-sc.gc.ca
Téléphone : 613-964-6522
Télécopieur : 613-952-7738
Vous pouvez signaler les effets secondaires soupçonnés associés à l’utilisation de produits de santé à Santé Canada :
- Composez sans frais le 1-866-234-2345; ou
- Consultez la page Web MedEffet Canada sur la déclaration des effets indésirables pour savoir comment déclarer un effet indésirable en ligne, par courrier ou par télécopieur.

