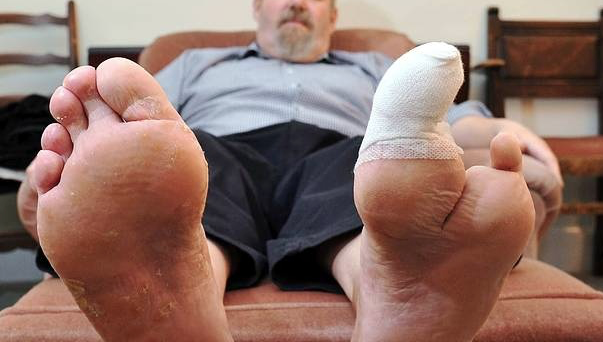
Nicht so gut: Erhöhtes Risiko für Amputationen der unteren Extremitäten mit SGLT2-Inhibitoren
Last Updated on April 18, 2017 by Joseph Gut – thasso
11. Februar 2017 – Nicht so gut, diese Nachricht für Diabetes-Patientinnen und -Patienten. Der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) bei der Europäischen Arzneimittel-Agentur (EMA) warnt, dass in zwei klinischen Prüfungen, CANVAS und CANVAS-R, eine größere Anzahl von Amputationen der unteren Extremitäten (vorwiegend der Zehen) bei Patienten beobachtet worden ist, die das Diabetesmittel Canagliflozin (Invokana) erhielten verglichen mit denen, die ein Placebo erhielten. Die noch laufenden Studien umfassten Patienten mit erhöhtem Risiko von Herzproblemen.

Diabetes-Patienten und -Patientinnen (besonders solche mit schlecht eingestelltem Diabetes und mit bestehenden Problemen des Herzens und der Blutgefäße) sind einem erhöhten Risiko von Infektionen und Geschwüren ausgesetzt, die zu Amputationen führen können. Der molekulare Mechanismus, nach dem Canagliflozin das Risiko von Amputationen vergrößern kann, ist noch unklar.
Ein erhöhtes Risiko wurde in Studien mit den anderen Arzneimitteln in derselben Klasse, d.h., mit den Wirkstoffen Dapagliflozin und Empagliflozin, bisher nicht gesehen. Gleichwohl könnte, basierend auf dem gleichen pharmakologischen Wirkungsmechanismus (d.h., Hemmung des SGLT-2 (Sodium-Glucose Linked Transporter 2), auch ein Risiko für andere Arzneimittel derselben Klasse bestehen, da die bis heute verfügbaren Daten lückenhaft sind. Weitere Daten werden von den laufenden Studien mit den Wirkstoffen Canagliflozin, Dapagliflozin und Empagliflozin erwartet.
Auf der Grundlage der verfügbaren Daten empfiehlt der PRAC, dass ein Warnhinweis zum Risiko von Amputationen der unteren Extremitäten (vorwiegend der Zehen) in die Produktinformationen für diese Arzneimittel aufgenommen werden sollte, der auch die Wichtigkeit einer regelmäßigen, vorbeugenden Fußpflege hervorhebt. Bei Canagliflozin sollten Amputationen der unteren Extremitäten (vorwiegend der Zehen) als gelegentlich vorkommende Nebenwirkung (1 -10 von 1.000 Patienten) adressiert werden. Ärzte sollten auch in Betracht ziehen, die Behandlung mit Canagliflozin abzubrechen, wenn Patienten ausgeprägte Komplikationen an den Füßen, wie Infektionen oder Hautgeschwüre, entwickeln.
Die PRAC-Empfehlung wird jetzt dem Ausschuss für Humanarzneimittel (CHMP) zur Begutachtung übermittelt. Weitere Details und Hinweise für Patienten und Gesundheitsexperten werden nach der finalen CHMP-Meinungsbildung veröffentlicht werden.
Canagliflozin, Dapagliflozin und Empagliflozin sind Wirkstoffe zur Behandlung des Diabetes Typ 2 und Inhibitoren des Natrium-Glukose-Cotransporters 2 (SGLT2); sie werden als SGLT2-Inhibitoren bezeichnet. Sie blockieren ein Protein (SGLT2), das in den proximalen Nierentubuli den Großteil der filtrierten Glukose reabsorbiert. Damit verringern sie die Rückresorption von Glukose, steigern die renale Ausscheidung und verringern die Plasmaglukosekonzentration.
Die folgenden Arzneimittel, die SGLT2-Inhibitoren enthalten, sind zurzeit in der EU zugelassen: Ebymect (Dapagliflozin/Metformin), Edistride (Dapagliflozin), Forxiga (Dapagliflozin), Glyxambi (Empagliflozin/Linagliptin), Invokana (Canagliflozin), Jardiance (Empagliflozin), Qtern (Saxagliptin/Dapagliflozin), Synjardy (Empagliflozin/Metformin), Vokanamet (Canagliflozin/Metformin) und Xigduo (Dapagliflozin/Metformin).
Das Risikobewertungsverfahren nach Artikel 20 der Richtlinie 2001/83/EG zu Canagliflozin wurde auf Antrag der Europäischen Kommission am 15.4.2016 eingeleitet, es wurde um Arzneimittel der derselben Klasse, Dapagliflozin und Empagliflozin, am 7.Juli 2016 erweitert. Der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC), der für die Bewertung von Risikoaspekten bei Humanarzneimitteln verantwortlich ist, hat das Verfahren durchgeführt und einen Empfehlungskatalog erstellt. Die Empfehlungen des PRAC werden dem Ausschuss für Humanarzneimittel (CHMP) als fachliche Grundlage seiner Begutachtung dienen. Abschließend wird die Europäische Kommission eine rechtlich bindende Entscheidung für alle EU-Mitgliedstaaten treffen.







In ihrer Drug Safety Mail 2017-15 orientiert die Arzneimittelkommission der deutschen Ärzteschaft folgendermassen:
10.05.2017 – SGLT-2-Inhibitoren: Beschluss der Europäischen Kommission zum möglicherweise erhöhten Risiko für Amputationen der unteren Extremitäten
SGLT-2-Inhibitoren (Canagliflozin, Dapagliflozin, Empagliflozin) sind zugelassen zur Behandlung des Diabetes mellitus Typ 2 in Mono- oder Kombinationsbehandlung als Ergänzung zu Diät und Bewegung. Sie blockieren den Natrium-Glukose-Cotransporter-2 (SGLT-2) in der Niere und erhöhen so die Ausscheidung von Glukose über den Urin, was konsekutiv den Blutzuckerspiegel senkt.
In einer Langzeituntersuchung zu kardiovaskulären Endpunkten war für Canagliflozin ein erhöhtes Risiko für Amputationen der unteren Extremitäten beobachtet worden (vgl. Informationsbrief vom 2. Mai 2016). Der Mechanismus ist nicht bekannt. Da ein Gruppeneffekt der SGLT-2-Inhibitoren nicht ausgeschlossen werden kann, hat die Europäische Kommission auf Empfehlung des Ausschusses für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) bei der Europäischen Arzneimittel-Agentur (EMA) (vgl. Drug Safety Mail 2017-07) beschlossen, einen Warnhinweis zum Risiko von Zehenamputationen in die Produktinformationen der SGLT-2-Inhibitoren aufzunehmen. Alle Patienten, die diese Arzneimittel einnehmen, sollten auf die Notwendigkeit der routinemäßigen Fußpflege hingewiesen werden. Für Canagliflozin, das in Deutschland nicht verfügbar ist, wurden weitere Empfehlungen abgegeben.
Siehe hier: <http://www.akdae.de/Arzneimittelsicherheit/DSM/Archiv/2017-15.html>