Medicine theragenomique en action: Tarceva® (erlotinib) n’est plus indiqué dans le traitement de maintenance chez les patients dont les tumeurs ne présentent pas de mutation activatrice du récepteur du facteur de croissance épidermique (EGFR).

Last Updated on février 1, 2016 by Joseph Gut – thasso
19 Janvier 2016 – Ce message concernant l’indication pour Tarceva® vient de l’ANSM. L’étude IUNO a conclu que le rapport bénéfice-risque de Tarceva® n’est plus considéré comme favorable dans le traitement de maintenance des formes localement avancées ou métastatiques du cancer bronchique non à petites cellules (CBNPC) après 4 cycles d’une première 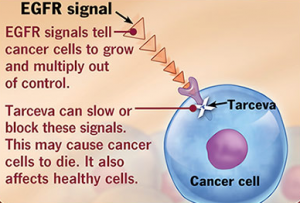 ligne de chimiothérapie standard à base de sels de platine chez les patients dont les tumeurs ne présentent pas de mutation activatrice du récepteur du facteur de croissance épidermique (EGFR).
ligne de chimiothérapie standard à base de sels de platine chez les patients dont les tumeurs ne présentent pas de mutation activatrice du récepteur du facteur de croissance épidermique (EGFR).
L’indication en première ligne de traitement de maintenance est désormais la suivante : “Tarceva® est également indiqué dans le traitement de maintenance des formes localement avancées ou métastatiques du CBNPC chez les patients avec mutation activatrice de l’EGFR et présentant une maladie stable après une première ligne de chimiothérapie”.
L’étude IUNO était une étude de phase III, randomisée, en double aveugle, contrôlée versus placebo comparant Tarceva® administré en première ligne de traitement de maintenance versus Tarceva® administré au moment de la progression de la maladie chez des patients atteints d’un CBNPC avancé dont les tumeurs ne présentent pas de mutation activatrice de l’EGFR (délétion de l’exon 19 ou mutation L858R de l’exon 21) et qui n’ont pas progressé après 4 cycles de chimiothérapie à base de sels de platine. Les patients ont été randomisés pour recevoir, en traitement de maintenance, Tarceva® ou le placebo suivi respectivement d’une chimiothérapie/soins de supports ou de Tarceva® jusqu’à progression de la maladie.
La survie globale n’était pas supérieure chez les patients randomisés qui ont reçu Tarceva® en traitement de maintenance suivi par une chimiothérapie jusqu’à progression, comparé aux patients randomisés qui ont reçu le placebo en traitement de maintenance suivi de Tarceva® jusqu’à progression (HR = 1,02 ; IC 95 % ; 0,85 à 1,22 ; p = 0,82). Pendant la phase de maintenance, les patients qui ont reçu Tarceva® n’ont pas montré de survie sans progression supérieure comparé aux patients qui ont reçu le placebo (HR = 0,94 ; IC 95 % ; 0,80 à 1,11 ; p = 0,48). Sur la base des résultats observés dans l’étude IUNO, Tarceva® n’est plus indiqué dans le traitement de maintenance chez les patients sans mutation activatrice de l’EGFR. Donc l’adaption de l’indication si dessus.

